Retroviruses, endogenní retroviry, receptory pro vstup retrovirů, restrikční faktory, antivirová vrozená imunita, editace genů u drůbeže, syncytiny, epigenetická suprese retrovirů
Replikace retrovirů v hostitelských buňkách je výsledkem interakcí mezi virem a řadou buněčných faktorů, a to buď faktorů, jež virus nezbytně potřebuje v jednotlivých krocích replikačního cyklu, nebo restrikčními faktory, jež blokují replikaci viru a přispívají k přirozené antivirové imunitě. Hlavním zaměřením naší skupiny jsou receptory pro retroviry, jež umožňují specifickou vazbu viru a pomáhají při jeho vstupu do buňky. Virus ptačí leukózy (ALV), důležitý patogen u kura domácího, se dělí do několika podskupin lišících se využitím receptorů. To vytváří příležitost studovat koevoluci viru a hostitele a adaptaci viru pro nového hostitele (1). Praktickým výstupem tohoto výzkumu jsou inovativní techniky editace genomu kuřete pomocí CRISPR/Cas9 (vyvíjené spolu s partnery z komerční sféry) a manipulace s geny pro receptory ALV s cílem získat kuřecí linie rezistentní k viru (2).
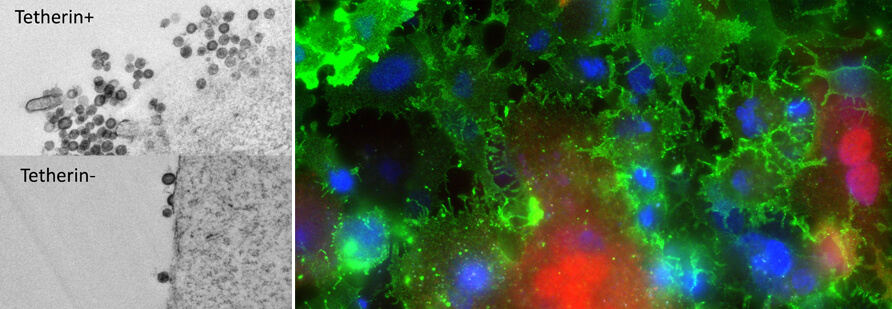
Při práci s ptačími retroviry potřebujeme také silné zázemí v genetice a genomice ptáků, zejména kuřat. Naše analýzy částí kuřecího genomu bohatých na GC (4) vedly k objevu několika genů, jež byly dříve v linii hrabavých ptáků považovány za ztracené (geny pro TNF- a , BST-2, PTX3, EPO, EPOR, FoxP3 atd.). V kombinaci s úpravou genu CRISPR/Cas9 v buněčných liniích nebo in vivo jsme nyní schopni testovat biologické aktivity těchto genů a porovnávat je s funkcemi u jiných obratlovců. Například kuřecí BST-2/Tetherin vykazuje antivirovou aktivitu proti ALV (obr. 1 vlevo) a potenciálně proti dalším obaleným virům (ptačí chřipka, ptačí koronaviry atd.). Faktory přirozené imunity budou v budoucnu zvláště zajímavé.
Zajímají nás také endogenní retroviry v genomu obratlovců, jež jsou pozůstatkem dávných infekcí. Identifikovali jsme endogenní lentiviry a deltaretroviry v různých liniích savců – nejstarší molekulární fosilie příbuzné s HIV a HTLV. Endogenní retroviry nabývají neočekávaných funkcí, jako např. syncytin-1, který je nevyhnutelný pro fúzi mezi buňkami v lidské placentě (obr. 2 vpravo). Zaměřujeme se na receptor pro syncytin-1 (přenašeč aminokyselin hASCT2) a epigenetickou regulaci exprese syncytinu-1 (5), která se fyziologicky vyskytuje v placentě a aberantně u nádorů zárodečné linie. Epigenetická regulace integrovaných retrovirů byla prokázána již dříve u infekce HIV-1, kde je přetrvávání CpG-metylovaných a transkripčně umlčených provirů hlavní překážkou funkčního vyléčení. Protože umlčení proviru silně závisí na místě integrace a jeho epigenetických vlastnostech, provádíme také celogenomové analýzy preference integrace retrovirů a distribuce provirů.